DR (ドラッグリポジショニング)
DR(ドラッグ・リポジショニング)とは
DR(ドラッグ・リポジショニング)とは、ヒトでの安全性と体内動態が充分に証明されている既承認薬の新しい薬理効果を発見し、別の疾患治療薬として開発する戦略です。
当社のDRの特徴
当社は日本で最初にDRの重要性を指摘し、DRのリーティングカンパニーとして発展してきました。
既承認薬ライブラリを用いた医薬品スクリーニング
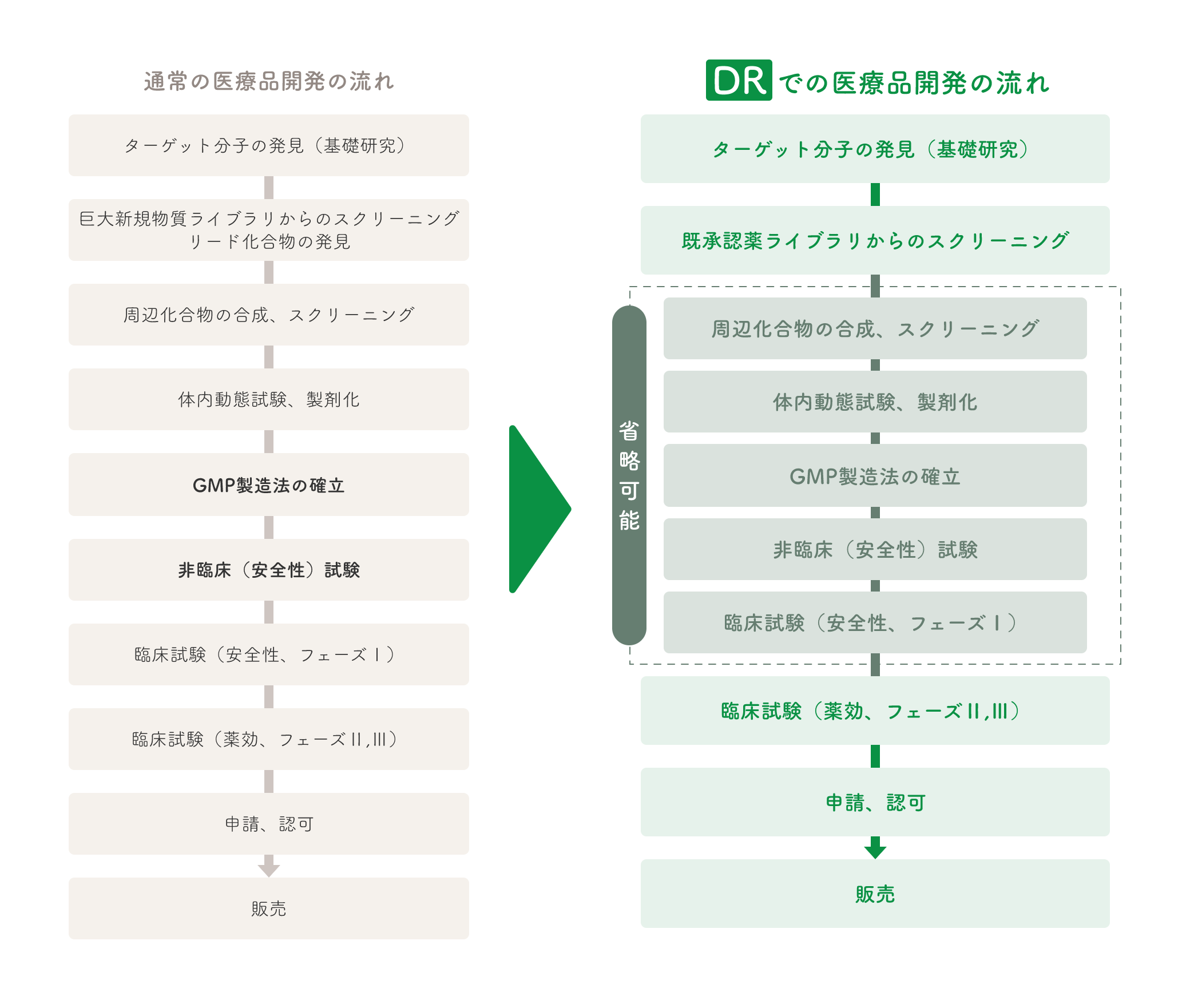
DRを効率的に進めるために当社は、日本および米国で承認された薬(既承認薬)を集めた化合物ライブラリを独自に構築しました。そしてこれを用いて様々なスクリーニングを行いDRを進めてきました(COPD、ドライアイなど)。また、このライブラリと研究費を提供し、アカデミアと共同研究を行う事業も展開しています。
既承認薬をリード化合物として用いる新薬開発
スクリーニングで得られた既承認薬の薬効をさらに高めるために、あるいは物質特許を得るために当社は、既承認薬をリード化合物として誘導体を合成し、新規物質を創製してきました(LT-3001、LT-3002など)。
開発中止品のDRによる復活
臨床での安全性は確認されたものの、薬効不足などにより臨床開発が中断した化合物(お蔵入り新薬)を抱える製薬企業は多く、DRにより新たな薬理効果を発見し別の疾患治療薬として開発することができれば、大きなメリットとなります。当社は大手企業からこのようなDRを受託するビジネスも行っており、特許を共同で出願した実績もあります。
DR研究の利点
医薬品開発におけるDRの利点として以下の点が挙げられます。

副作用で臨床試験が失敗する
リスクが低い。

既にあるデータを利用できるので
開発にかかる時間とコストを削減できる。

インシリコスクリーニングや
インシリコ臨床試験が可能。
これまでの事例

既承認薬ライブラリを用いたCOPD治療薬の開発

既承認薬ライブラリを用いたドライアイ治療薬の開発

DRを利用した副作用の少ない抗炎症薬の開発

製薬企業から適応拡大研究の受託

既承認薬ライブラリを用いたアカデミアとの共同研究
DRによる医薬品開発の流れ
DRグラント
既承認薬ライブラリと研究費を提供し、アカデミアとの共同研究を行う事業を展開しています。詳しくはこちらのページをご覧ください。
コンサルテーション・教育活動
DRの先駆者であり、DRに関する経験と多くのノウハウを持つ当社がご相談に乗ります。 詳しくはこちらのページをご覧ください。
ライセンスイン/共同開発
企業(特に中小企業やベンチャー企業)を対象に共同研究開発契約を結び、新薬の開発をサポートしています。詳しくはこちらのページをご覧ください。
受託研究/コンサルテーション
DRの先駆者であり、DRに関する経験と多くのノウハウを持つ当社がスクリーニング、知財化、臨床試験への橋渡しなどに困っているDR案件に関してコンサルテーションを実施しています。詳しくはこちらのページをご覧ください。